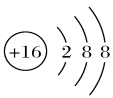
出土的锡青铜(铜锡合金)文物常有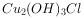 覆盖在其表面。下列说法正确的是( )。
覆盖在其表面。下列说法正确的是( )。
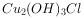 覆盖物是电化学腐蚀过程,但不是化学反应过程
覆盖物是电化学腐蚀过程,但不是化学反应过程(Bi)在医药方面有重要应用,下列关于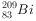 和
和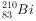 的说法正确的是( )。
的说法正确的是( )。
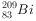 和
和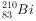 都含有83个中子
都含有83个中子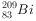 和
和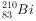 互为同位素
互为同位素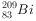 和
和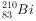 的核外电子数不同
的核外电子数不同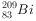 和
和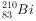 分别含有126和127个质子
分别含有126和127个质子下列有关化学使用正确的是( )。
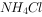 的电子式:
的电子式: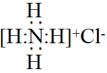
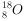
设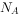 为阿伏加德罗常数的值。下列叙述不正确的是( )。
为阿伏加德罗常数的值。下列叙述不正确的是( )。
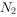 和
和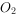 的混合气体中原子数为0.2
的混合气体中原子数为0.2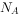
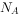
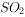 与足量的
与足量的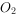 充分反应后可得到
充分反应后可得到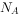 个
个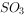 分子
分子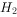 和0.1mol
和0.1mol 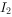 于密闭容器中充分反应后,其分子总数为0.2
于密闭容器中充分反应后,其分子总数为0.2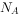
某同学购买了一瓶“84消毒液”,包装说明如下:
净含量:500mL
密度:1.19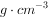
主要成分:25% 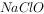
使用方法:稀释100倍(体积比)后使用
注意事项:密封保存,易吸收空气中的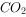 变质
变质
请根据以上信息和相关知识判断,下列分析不正确的是( )。
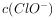 约为0.004
约为0.004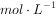
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是( )。
下列反应的方程式书写正确的是( )。
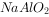 溶液中通入过量的
溶液中通入过量的 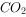 :
: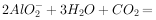
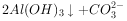
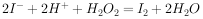
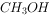
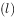 的燃烧热为 238.6
的燃烧热为 238.6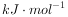 ,则
,则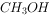
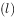 +
+ 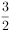
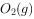
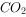
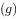
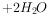
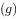
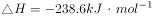
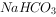 溶液和少量
溶液和少量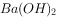 溶液混合:
溶液混合: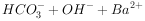
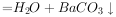
气体X只可能含有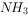 、
、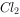 、HBr、
、HBr、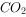 中的一种或几种。已知X通入硝酸银溶液时产生淡黄色、不溶于稀硝酸的沉淀,若将X通入澄清石灰水中没有沉淀产生。则下列有关气体X的成分的说法正确的是( )。
中的一种或几种。已知X通入硝酸银溶液时产生淡黄色、不溶于稀硝酸的沉淀,若将X通入澄清石灰水中没有沉淀产生。则下列有关气体X的成分的说法正确的是( )。
二氯化二硫(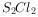 )是广泛用于橡胶工业的硫化剂,其分子结构如右图所示。常温下,
)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示。常温下,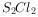 遇水易与水发生反应,并产生能使品红褪色的气体。下列说法错误的是( )。
遇水易与水发生反应,并产生能使品红褪色的气体。下列说法错误的是( )。
 的结构中各原子均达到8电子的稳定结构
的结构中各原子均达到8电子的稳定结构 为含有极性键和非极性键的共价化合物
为含有极性键和非极性键的共价化合物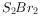 与
与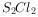 结构相似,则熔沸点:
结构相似,则熔沸点: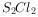 >
>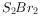
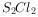 与
与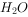 反应的化学方程式可能为:
反应的化学方程式可能为: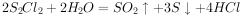
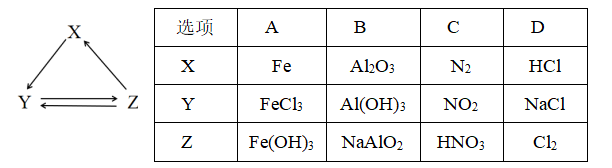
下列各组物质中,物质之间通过一步反应能实现如下图所示转化的是( )。
分类是化学学习的一种重要方法,下列有关分类正确的是( )。
①混合物:氯水、氨水、水玻璃、水银、福尔马林、淀粉
②含有氧元素的化合物叫氧化物
③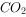 、NO、
、NO、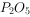 均为酸性氧化物,
均为酸性氧化物,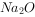 、
、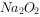 均为碱性氧化物
均为碱性氧化物
④同位素: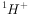 、
、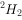 、
、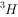
⑤同素异形体: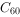 、
、 、金刚石、石墨
、金刚石、石墨
⑥浓盐酸、浓硫酸、浓硝酸均具有氧化性,都属于氧化性酸
⑦化合物:烧碱、冰醋酸、HD、聚氯乙烯
⑧强电解质溶液的导电能力一定强
⑨在熔融状态下能导电的化合物为离子化合物
⑩有单质参加的反应或有单质产生的反应是氧化还原反应
我国在 催化加氢制取汽油方面取得突破性进展,
催化加氢制取汽油方面取得突破性进展, 转化过程示意图如下:
转化过程示意图如下:
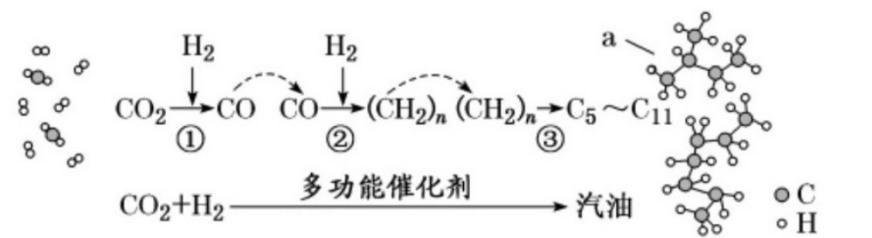
下列说法不正确的是( )。
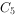 ~
~ 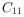 的烃类混合物
的烃类混合物下列各组离子能在指定溶液中大量共存的是( )。
①酸性溶液中: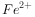 ,
,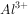 ,
,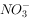 ,
,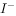 ,
,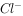 ,
,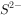
②室温下,pH=11的溶液中: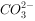 ,
,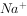 ,
,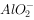 ,
,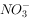 ,
,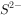 ,
,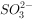
③加入Al能放出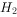 的溶液中:
的溶液中: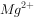 ,
,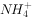 ,
,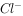 ,
,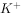 ,
,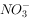
④使石蕊变红的溶液中: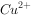 ,
,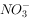 ,
,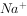 ,
,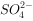
⑤室温下,水电离的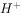 浓度
浓度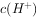 =
=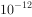 mol/L的溶液中:
mol/L的溶液中: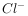 ,
,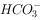 ,
,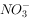 ,
,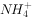 ,
,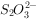
下列化学实验事实及解释都正确的是( )。
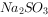 溶液中加入硝酸酸化的
溶液中加入硝酸酸化的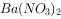 溶液,有白色沉淀出现,说明
溶液,有白色沉淀出现,说明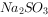 溶液已经变质
溶液已经变质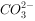
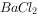 溶液,产生白色沉淀,加稀硝酸后,白色沉淀不溶解,说明该溶液中一定含有
溶液,产生白色沉淀,加稀硝酸后,白色沉淀不溶解,说明该溶液中一定含有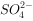
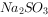 样品溶于水,加足量盐酸有气体产生,然后加
样品溶于水,加足量盐酸有气体产生,然后加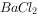 溶液,产生白色沉淀,说明
溶液,产生白色沉淀,说明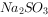 样品已部分变质
样品已部分变质实验室在500℃时隔绝空气加热硫酸亚铁铵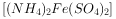 至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有
至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有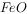 、
、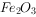 和
和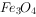 ,气体产物可能有
,气体产物可能有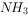 、
、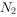 、
、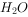 、
、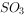 和
和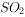 )。下列说法正确的是( )。
)。下列说法正确的是( )。
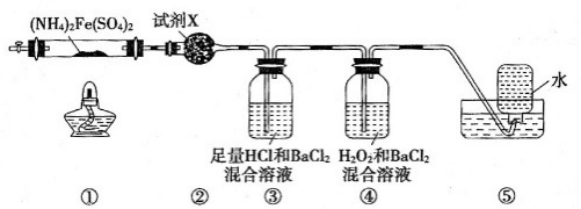
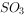 气体生成并除去
气体生成并除去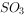 和
和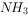
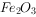
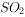 气体生成,装置⑤用于收集生成的
气体生成,装置⑤用于收集生成的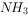 和
和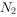
氢化铝锂(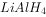 )和硼氢化钠(
)和硼氢化钠(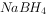 )都是有机合成中非常重要的还原剂,可发生如下反应:
)都是有机合成中非常重要的还原剂,可发生如下反应:
①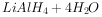
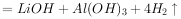
②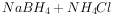
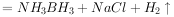
则下列说法错误的是( )。
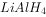 和
和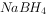 中H元素均为-1价
中H元素均为-1价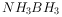 会转移2
会转移2 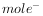
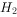 均既是氧化产物,又是还原产物
均既是氧化产物,又是还原产物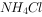 和
和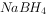 含化学键类型相同
含化学键类型相同萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )。
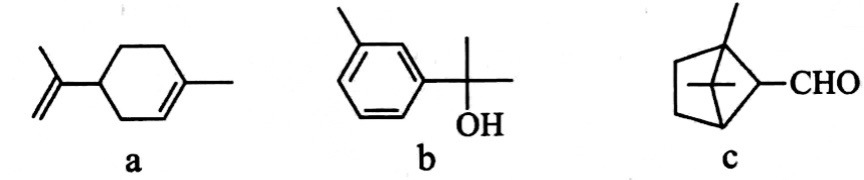
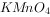 液褪色
液褪色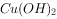 反应生成红色沉淀
反应生成红色沉淀温度为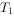 时,在三个容积均为1L的恒容密闭容器中仅发生反应:
时,在三个容积均为1L的恒容密闭容器中仅发生反应: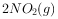 ⇌
⇌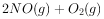 (正反应吸热),实验测得:
(正反应吸热),实验测得: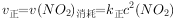 ,
,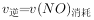
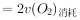
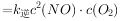 ,
,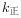 、
、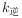 为速率常数,受温度影响。下列说法正确的是( )。
为速率常数,受温度影响。下列说法正确的是( )。
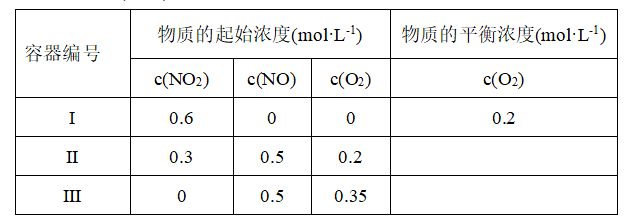
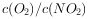 比容器I中的大
比容器I中的大 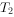 时,若
时,若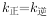 ,则
,则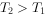
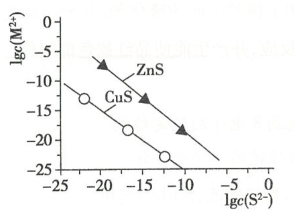
温度25℃时,用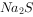 沉淀
沉淀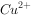 、
、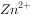 两种金属离子(
两种金属离子(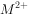 ),所需
),所需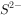 最低浓度的对数值
最低浓度的对数值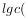
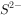
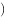 与
与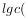
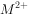
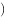 关系如图所示。下列说法不正确的是( )。
关系如图所示。下列说法不正确的是( )。
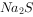 溶液中:
溶液中: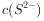
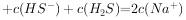
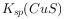 约为
约为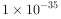
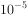 mol/L的
mol/L的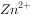 、
、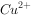 混合溶液中逐滴加入
混合溶液中逐滴加入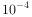 moL/L的
moL/L的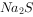 溶液,
溶液,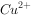 先沉淀
先沉淀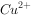 浓度为
浓度为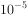 mol/L的废水中加入ZnS粉末,会有CuS沉淀析出
mol/L的废水中加入ZnS粉末,会有CuS沉淀析出—种测定水样中溴离子的浓度的实验步骤如下:
①向锥形瓶中加入处理后的水样25.00mL,加入几滴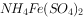 溶液。
溶液。
②加入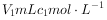
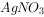 溶液(过量),充分摇匀。
溶液(过量),充分摇匀。
③用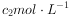 KSCN标准溶液进行滴定,至终点时消耗标准溶液
KSCN标准溶液进行滴定,至终点时消耗标准溶液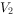 mL。
mL。
已知: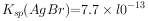 ,
,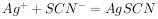 (白色)↓,
(白色)↓,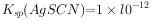 ,下列说法不正确的是( )。
,下列说法不正确的是( )。
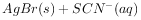
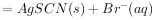 的平衡常数K= 0.77
的平衡常数K= 0.77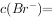
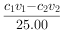
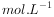
(5分)现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A与D、C与E分别同主族,D、E、F同周期,B原子的最外层电子数是内层电子数的2.5倍,A与C形成的常见化合物在常温下为液态。
(1)B、C、E三种元素中非金属性最强的是 (填元素符号)。
(2)常温下,F的单质能与由A、C、D三种元素组成的一种常见化合物发生反应,该反应的化学方程式为 。
(3)E与F的最简单气态氢化物中稳定性较强的是 (填化学式)。
(4)元素B和元素F能形成一种化合物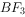 ,其中F显+1价。
,其中F显+1价。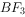 能发生水解反应生成一种弱碱和一种弱酸,写出该反应的化学方程式: 。
能发生水解反应生成一种弱碱和一种弱酸,写出该反应的化学方程式: 。
(10分)半导体生产中常需要使用掺杂剂以保证控制电阻率,三氯化磷(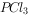 )是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的
)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的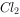 模拟工业生产制取
模拟工业生产制取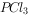 ,装置如图所示:(部分夹持装置略去)
,装置如图所示:(部分夹持装置略去)
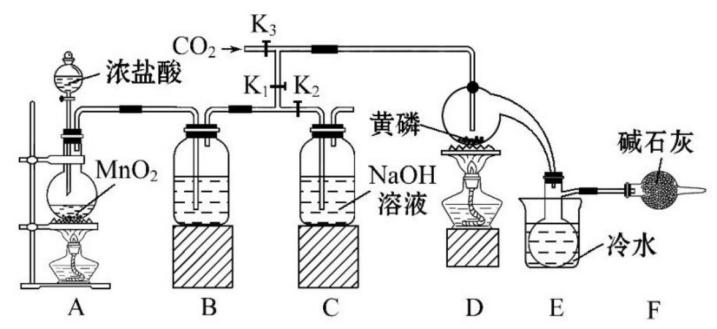
已知:①黄磷与少量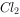 反应生成
反应生成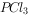 ,与过量
,与过量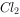 反应生成
反应生成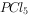 ;②
;②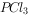 遇水会强烈水解生成
遇水会强烈水解生成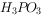 和HCl;③
和HCl;③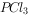 遇
遇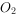 会生成
会生成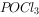 ,
,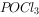 溶于
溶于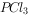 ;④
;④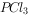 、
、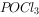 的熔沸点见下表:
的熔沸点见下表:
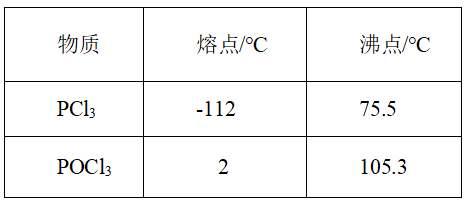
请回答下列问题:
(1)B中所装的试剂是 ,F中碱石灰的作用是 。
(2)实验时,检查装置气密性后,先打开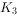 、关闭
、关闭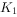 ,通入干燥的
,通入干燥的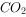 ,再迅速加入黄磷。通干燥
,再迅速加入黄磷。通干燥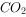 的作用是 ,通过控制
的作用是 ,通过控制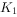 、
、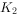 能除去A、B装置中的空气,具体的操作是 。
能除去A、B装置中的空气,具体的操作是 。
(3)粗产品中常含有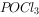 、
、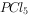 等。加入黄磷加热除去
等。加入黄磷加热除去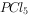 后,通过 (填实验操作名称),即可得到较纯净的
后,通过 (填实验操作名称),即可得到较纯净的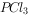 。
。
(4)通过下面方法可测定产品中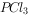 的质量分数:
的质量分数:
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入淀粉作为指示剂;
③向其中加入0.1000 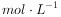 碘水,充分反应,当达到终点时消耗碘水溶液6.9 mL。
碘水,充分反应,当达到终点时消耗碘水溶液6.9 mL。
已知: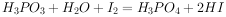 ,假设测定过程中没有其他反应。
,假设测定过程中没有其他反应。
滴定时,滴定终点的现象是 ,配制0.1000 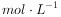 的碘水溶液的过程中,下列操作会使所得溶液浓度偏大的是 。
的碘水溶液的过程中,下列操作会使所得溶液浓度偏大的是 。
A.烧杯中溶液转移至容量瓶中时,未洗涤烧杯
B.定容时俯视刻度线
C.定容时仰视刻度线
D.容量瓶未干燥
E.移液时有少量液体溅出
F.溶解碘时放热,未冷却至室温就转移至容量瓶并定容
根据上述数据,该产品中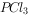 的质量分数为 。(保留一位小数)
的质量分数为 。(保留一位小数)
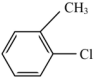
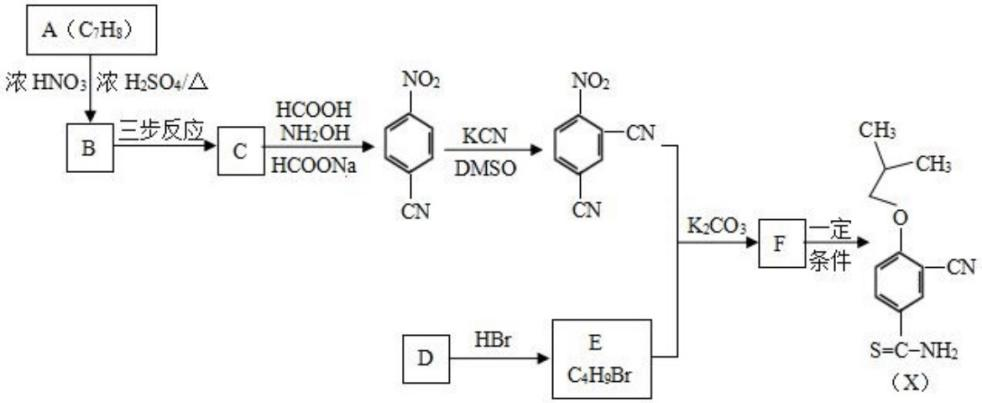
(15分)有机物X是合成抗痛风药非布司他的一种中间体,其合成路线如下图所示:
已知: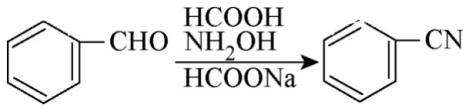
(1)A是一种重要的化工原料和有机溶剂,其结构简式是 。
(2)A→B的反应类型是 。
(3)C中所含的官能团是 。
(4)B→C可通过三步反应完成,请选择必要的无机试剂完成该转化,写出有关反应的化学方程式 , , 。
(5)D是一种烃,D→E时可能产生的副产物结构简式是 。
(6)F与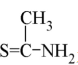 在一定条件下反应生成X,写出F的结构简式 。
在一定条件下反应生成X,写出F的结构简式 。
